Die Entstehung des Lebens bleibt eines der größten (noch) unbeantworteten Rätsel der Wissenschaft. Wie konnten sich die notwendigen chemischen Bausteine unter den Bedingungen der frühen Erde bilden und wie konnten sie sich zu einer ersten "lebenden" Protozelle verbinden? Der Chemie kommt bei der Beantwortung dieser Frage eine Schlüsselrolle zu und hier konnten in den letzten 20 Jahren aufregende Erfolge erzielt werden: Ein Rückblick.
Seit der sowjetische Biochemiker Alexander Oparin 1924 in seinem Buch "Die Entstehung des Lebens auf der Erde" die Hypothese aufstellte, dass wir nicht "von einem absoluten und grundsätzlichen Unterschied zwischen lebender und toter Materie sprechen müssen" und, dass "Leben eine neue Form der Existenz der Materie ist, die unbedingt als eine bestimmte Etappe in der historischen Entwicklung von Materie auftreten musste", versuchen Chemiker eine Brücke zur Biologie zu bauen.1 2 3
Um zu wissen, wonach gesucht wird, bedarf es zunächst einer Definition von Leben. Die gängige Definition aus biologischer Perspektive beinhaltet mindestens drei Kriterien: Reproduktion, Metabolismus und Mutation.3 Über zusätzliche Kriterien besteht bis heute kein Konsens, es besteht jedoch der Verdacht, dass diese ohnehin aus den erstgenannten ableitbar sind. Nur durch Reproduktion, gepaart mit gelegentlichen Veränderungen des Erbmaterials (Mutation) ist der Prozess der natürlichen Selektion vorstellbar. Ein Stoffwechsel (Metabolismus) ist notwendig, um nachhaltige Wachstums-Reproduktionszyklen zu durchlaufen und einen geordneten, d. h. energiereichen, Zustand des lebenden Systems zu erhalten. Dies bedeutet, dass zumindest eine Aufnahme von Molekülen erfolgen muss, die in diesem Kontext als Nährstoffe bezeichnet werden können. Da Viren keinen eigenen Metabolismus aufweisen, entsprechen sie dieser Definition von Leben nicht. Ohne den Metabolismus einer lebenden Wirtszelle auszunutzen, können sie sich nicht reproduzieren.
Die Protozelle
Trotz der beeindruckenden makroskopischen Vielfalt sind sich alle Lebewesen, so wie wir sie auf der Erde kennen, auf mikroskopischer Ebene verblüffend ähnlich. Die kleinste funktionale Einheit aller Lebewesen ist die Zelle und die Erbinformation besteht aus nur wenigen identischen chemischen Bausteinen. Diese Tatsache weist stark auf gemeinsame Vorfahren hin. Diese ersten hypothetischen Lebewesen werden Protozellen genannt.
Wissenschaftler versuchen nun herauszufinden, wie eine funktionierende Protozelle aufgebaut sein könnte, wie die einzelnen Bausteine zusammenfanden und wie diese Bausteine wiederum unter den primitiven Reaktionsbedingungen der Urerde entstanden sein könnten.
Wahrscheinlich waren Protozellen nur ca. 0,1 µm im Durchmesser, also etwa 10- bis 100-fach kleiner als die meisten heutigen Zellen. Auf schematischen Darstellungen sind daher schon die einzelnen Atome und die daraus gebildeten Moleküle erkennbar. Das derzeit einfachste und bekannteste Modell für eine Protozelle besteht aus nur 2 Molekülklassen: Lipiden und Nukleotiden. Die Zellmembran wird aus Lipiden aufgebaut und im Inneren der Zelle befinden sich Polynukleotide (siehe Titelbild).
Die Hülle der Protozelle
Zur Klasse der Lipide gehört z. B. die Decansäure. Das Geheimnis eines solchen Moleküls ist, dass es aus zwei Teilen besteht, die sehr unterschiedliche Eigenschaften haben, aber durch eine chemische Bindung fest miteinander verknüpft sind. Der Säureteil ist sehr gut wassermischbar (wie Essigsäure), wohingegen der Decanteil nicht wassermischbar ist (wie Wachs). Gibt man solche Moleküle in Wasser, lagern sich diese selbstständig so zusammen, dass der wassermischbare Säureteil zum Wasser gerichtet ist und die nicht mischbaren Decanteile vom Wasser abgeschirmt werden. Es gibt verschiedene Gebilde, die diese Bedingung erfüllen. Es können kleine kompakte Kugeln sein (Mizellen) oder größere Zellen (wissenschaftlich Vesikel genannt), deren Wand aus einer Doppelschicht von Decansäure besteht. Der Säureteil der inneren Schicht zeigt dann nach innen und der Säureteil der äußeren Schicht nach außen, so dass sowohl im Inneren als auch außen von der kugelförmigen Zelle Wasser ist. Genau aus solchen Doppellipidschichten sind auch heute alle Zellmembranen aufgebaut. Ob eher Mizellen oder Vesikel (Zellen) bevorzugt gebildet werden, hängt von der Sorte der Lipidmoleküle und den äußeren Bedingungen ab, z. B. dem Säuregehalt des Wassers. Wichtig zu erwähnen ist, dass die Lipidmoleküle sich nur lose zusammenlagern und nicht fest miteinander verbunden sind. Innerhalb der Zellmembran tauschen sie ihre Plätze, sind ständig in Bewegung und können auch zeitweise die Zelle verlassen und in die Zellmembran einer anderen Zelle eingebaut werden. Es handelt sich sozusagen um eine "flüssige" Membran. Dadurch können kleine Nährstoffmoleküle in die Zelle eindringen. Alle diese Strukturen sind sehr klein und homogen im Wasser verteilt, so dass man sie mit dem Auge nicht sehen kann. Klar ist, dass die Bildung von Vesikeln ein normaler physikalischer Selbstorganisationsprozess ist, der keine separate Erbinformation benötigt, sondern rein durch die Eigenschaften der einzelnen Lipidmoleküle zu erklären ist. Dieser Prozess ist schon lange gut verstanden und wird in der chemischen Industrie aktiv ausgenutzt. Seife besteht ebenfalls aus solchen Molekülen und die Einlagerung von wasserunmischbarem Fett in die kugelförmigen Seifenmizellen ist dafür verantwortlich, dass wir nach dem Grillhähnchen essen wieder unsere Hände und Hemden sauber kriegen. Auch Seifenblasen lassen sich so erklären, nur dass noch Luft als dritte Komponente hinzukommt. Interessanterweise scheint die selbstständige Bildung von Seifenblasen weniger Verwunderung hervorzurufen, als dies Selbstorganisationsphänomene im Kontext der Evolution tun.
Ungeklärt war lange Zeit, wie unter milden Bedingungen Zellwachstum und Zellteilung stattfinden können. Hierzu wurden in Harvard im Labor des Nobelpreisträgers Jack Szostak faszinierende Studien durchgeführt. Seine Gruppe konnte 2009 zeigen, wie Zellen wachsen, wenn neue Lipidmoleküle in die wässrige Lösung gegeben werden. Noch wichtiger war aber zu beobachten, dass bei weiterer Zugabe lange Filamente aus der Zelle wachsen und die gesamte Zelle schließlich aus verzweigten dicken Filamenten besteht. In diesem Zustand reichen leichte Erschütterungen, um eine Teilung in mehrere kugelförmige Tochterzellen zu bewirken.4 Ein solches System erfüllt somit schon zwei Bedingungen des Lebens. Es kann Nahrung aufnehmen und es kann sich reproduzieren. Schwer vorstellbar ist allerdings wie sich eine solche Zelle weiterentwickeln könnte, da der Fortpflanzungserfolg rein von den Umgebungsbedingungen, z. B. der Nahrungszufuhr, abhängt und in keiner Form in der Zelle kodiert und an die Nachkommen weitergegeben wird. Hier kommt die zweite Komponente der Protozelle ins Spiel: Die Polynukleotide.
Selbstreplizierende Erbinformation
Wie der Name andeutet, handelt es sich bei Polynukleotiden um eine Kette aus einzelnen Nukleotidbausteinen. Da es vier verschiedene Nukleotidbausteine in diesem Modell gibt, können sie auf verschiedene Weise zu Ketten verknüpft werden. Schon eine Kette aus nur 10 Nukleotiden kann auf 410, d. h. gut eine Million Arten, verknüpft werden. Die einzigartige Verknüpfungssequenz eines Polynukleotids stellt die Erbinformation dar. Durch das Studium zellulären Lebens wurden bereits zwei eng miteinander verwandte Polynukleotide gut erforscht, DNA und RNA. Beide verwenden vier Nukleotidbausteine, die molekulare Struktur dieser Bausteine unterscheidet sich jedoch leicht. Heutige Zellen verwenden DNA zum Speichern ihrer Erbinformation, wohingegen RNA zum Übertragen von Informationen und zur Beschleunigung von chemischen Reaktionen (Katalyse) eingesetzt wird. Die Entdeckung der Katalysefunktion durch Thomas Chech und Sidney Altman wurde 1989 durch einen Nobelpreis ausgezeichnet. Diese Doppelfunktion der RNA, sprich Speicherung von Erbinformation und Reaktionsbeschleunigung, ist auch von zentraler Bedeutung für das vorgeschlagene Modell einer selbstreplizierenden Erbinformation.
Und so funktioniert die Selbstreplikation: Ein Nukleotidmolekül besteht aus drei Teilen: einer Nukleinbase, Ribose und einem Phosphat. Im Polynukleotid sind die Phosphatteile mit dem Riboseteil des nächsten Nukleotids in der Kette verknüpft, so dass sich Ribose und Phosphat im Rückgrat der Kette befinden, wohingegen die Nukleinbasen seitlich abstehen. Die korrekte Verknüpfungsreaktion zwischen einzelnen Nukleotiden zur RNA läuft aber nicht ohne Hilfestellung ab. Die Phosphatgruppe und die Ribosegruppe müssen nah zusammengebracht werden, um miteinander zu reagieren. Nun haben die seitlich von der RNA-Kette abstehenden Nukleinbasen noch eine besondere Eigenschaft. Sie bevorzugen die Anlagerung genau einer der vier Nukleinbasen. Dieser Prozess ist gut verstanden und folgt einem Schlüssel-Schloss-Prinzip. Die vier Nukleinbasen werden mit dem Anfangsbuchstaben ihres Namens abgekürzt, A für Adenin, C für Cytidin, U für Uracil und G für Guanin. Die bevorzugten Paare sind GC und AU. Man nennt diese komplementär zueinander. Nehmen wir jetzt eine kurze RNA-Sequenz aus sechs Nukleotiden von CCGUAG an. Gibt man nun eine Mischung aller vier Nukleotide in die Lösung zu unserer RNA-Sequenz, so werden sich diese entsprechend an dieser "Mini-RNA-Kette" anlagern, d. h. GGCAUC. Durch diese Anlagerung werden die Phosphatteile und Riboseteile der Nukleotide nah zusammengebracht und können sich leichter verknüpfen. So entsteht eine zweite RNA-Kette, die komplementär zur ersten ist. Bei etwas höheren Temperaturen können sich die beiden RNA-Ketten dann voneinander lösen. Das Interessante dabei ist, dass die neue komplementäre RNA-Kette natürlich auch als Vorlage für die Bildung der ursprünglichen RNA-Kette dienen kann. Somit enthält RNA nicht nur den Bauplan für eine komplementäre RNA, sondern im Prinzip auch den Bauplan für sich selbst. Nach diesem Prinzip könnten sich RNA-Ketten innerhalb von Zellen reproduzieren.
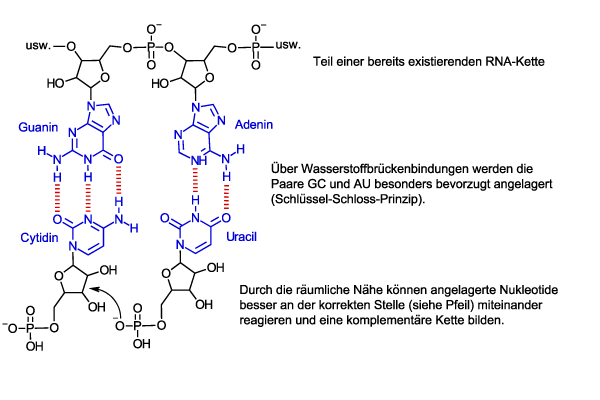
Der Haken an der Sache ist, dass die Reaktivität der Nukleotide auch mit diesem Anlagerungsprozess immer noch nicht ausreicht, um effektiv längere RNA-Ketten zu bilden. Eine weitere Hilfestellung ist nötig und hier kommt die Doppelfunktion der RNA ins Spiel. RNA-Ketten sind nicht steif, sondern sind im Wasser wie eine Spaghetti flexibel. Schauen wir uns unsere erste Beispielsequenz CCGUAG noch einmal an, sieht man, dass die Cytidinbase am Anfang der Kette sich auch an die Guaninbase derselben RNA-Kette anlagern könnte, so dass sich ein Ring bildet. Hat man nun deutlich längere Sequenzen, kann man sich vorstellen, dass sich viele solcher losen Querverbindungen durch Basenpaarung innerhalb derselben Kette bilden können, welche zu einer komplexen Knäuelbildung der "Spaghetti" führen. In diesem Knäuelzustand kann RNA auch als Katalysator wirken. Man nimmt also an, dass man für die Herstellung von RNA sowohl eine RNA-Kette als "Bauplan" und Vorlage benötigt, als auch eine "geknäuelte" RNA Kette, welche bei der Verknüpfung der einzelnen Nukleotide hilft.
In der Tat hatte man 1996 RNAs gefunden, die in der Lage sind, die Bildung anderer RNA-Sequenzen zu beschleunigen.5 Die ersten Exemplare waren aber noch sehr ineffektiv und konnten nur ca. 10 Nukleotide miteinander verknüpfen. Solche kurze Sequenzen reichen aber nicht aus, um ein wiederum katalytisch aktives "Knäuel" bilden zu können. Man nimmt an, dass man hierzu mindestens 30–40 Einheiten benötigt. Außerdem hatte man lange Zeit das Problem, dass eine effiziente Verknüpfung nur an RNA-Ketten mit vielen C-Einheiten als Vorlage funktionierte. Forscher am Scripps Research Institute in Kalifornien konnten 2016 jedoch eine RNA-Sequenz finden, welche auch an C-ärmeren Vorlagen als Katalysator zur Bildung von über 70 Einheiten langen RNAs funktionierte, welche wiederum selbst als Katalysator für andere chemische Reaktionen funktionierten.6 Allerdings sind noch weitere Verbesserungen in Reaktionsgeschwindigkeit und Kompatibilität mit komplexen RNA-Sequenzen nötig, um eine vollständige Selbstreplikation zu ermöglichen. Zwar scheint dieses Ziel in greifbarer Nähe zu sein, aber wie schon einleitend erwähnt, ist das Kriterium der Reproduktion nicht ausreichend für Leben.






28 Kommentare
Kommentare
Karol Dittel am Permanenter Link
Ist es nicht eher so, dass der Prozess der Abiogenese nie zum Stillstand gekommen ist oder anders gesagt immer noch aktiv ist ? Unsere Körper produzieren doch Tag für Tag "Lebendes aus Totem".
Ich weiß, dass bei der Diskussion es eher darum geht wie die erste "Lebende Materie" entstand. Also auch die ersten Baupläne des Lebens. Die heutige Umwandlung von unbelebter zu belebten Materie wird aufgrund schon vorhandenen Bauplänen aufgebaut. Das stimmt schon, dennoch sehe ich gelegentlich auch die heutigen Prozesse als eine Fortführung des Urprozesses. Naja... wie auch immer ;)
Hans Trutnau am Permanenter Link
Nun hatten wir ja gerade das Thema (https://hpd.de/artikel/schoene-rna-welt-16137); dort etwas stringenter.
Vermutlich gut gemeint, m.E. aber vergeigt.
[Anm. d. Mod.: Vielen Dank für den Hinweis. Die Interpunktion im Artikel wurde angepasst.]
Thomas Waschke am Permanenter Link
Sehe ich auch so. Habe gerade auch den verlinkten Artikel gelesen, der ist auch nicht klarer.
Seit ich mich mit dem Thema befasse (seit gut 45 Jahren) sind die üblichen (nicht nur die populärwissenschaftlichen) Arbeiten Sammlungen von Konjunktiven. So richtig geklärt ist nichts, man bildet sich ein, das Bild zu kennen (es muss funktioniert haben ...), und alles was nützlich sein könnte, wird als Bestätigung gewertet, und die vielen, vielen Fragen werden einfach mit Hoffnung auf die Zukunft beiseite geschoben (es muss schließlich funktioniert haben ...).
Wenn dann ein Frommer auftaucht und nachfragt, hackt man sofort auf dem herum, weil dessen Gott doch nicht aufzeigbar sei, er sich Illusionen hingebe und so weiter. Da wird dann eindeutig mit zweierlei Maß gemessen. Klar, an den Grenzen des Wissens beginnt Nichtwissen, nicht Wissen um einen Designer, aber eben auch nicht das Wissen, dass es keinen Designer gibt oder dass alles ohne einen ablaufen konnte. Etwas belesenere Theisten basteln sich ihren Gott sowieso auf eine Art und Weise, dass eine naturalistische Abiogenese kein Problem für sie wäre.
Atheisten sollten sich meiner Meinung nach ein wenig nach der Decke strecken. Wir wissen längst nicht so viel, vor allem nicht über Abiogenese, um die Nase so hoch tragen zu können.
Hans Trutnau am Permanenter Link
"Wir wissen längst nicht so viel, vor allem nicht über Abiogenese, um die Nase so hoch tragen zu können."
Sehe ich auch so - aber ich bin da auch nur ferner Beobachter.
Emmerich Lakatha am Permanenter Link
Ich weiß, dass ich subjektiv denke und geneigt bin, nicht genau überlegte Aussagen, zu machen.
Thomas Henninger am Permanenter Link
alle Fettsäuren gehören zu Gruppe der Lipide, so falsch war das nicht.
Hans Trutnau am Permanenter Link
Gebongt; bin da mit Lipid = Fett = Verbindung aus Glycerin und Fettsäuren etwas 'old school'.
Thomas Waschke am Permanenter Link
Ich habe sicherheitshalber zunächst gegoogelt. Klar, 'Lipid' ist umfassender als 'Fett'. Ich vermute aber, dass man aus Decansäure keine stabile Membran basteln kann.
In den ersten Ursuppen-Experimenten fand man derartige Substanzen nicht. Es war daher ein großes Problem, wie man Protobionten 'konstruieren' sollte, die auf eine Membran angewiesen sind. Die Proteinoide von Fox waren da nicht wirklich eine Lösung. Selbst Miller hat in der Retrospektive eingeräumt, dass der Hype angesichts dessen, was er herausfand, etwas überzogen war.
Fakt war, dass man davon ausgegangen war, dass es sehr schwer sei, Biomoleküle abiogen zu erzeugen. Dass es so einfach war, Aminosäuren zu erhalten, war daher ein Riesen-Schritt in die erhoffte Richtung. Aber eben in etwa so, wie wenn jemand im Garten einen Rucksack umschnallt und auf den Apfelbaum klettert und jubelt, dass nun der erste Schritt zur bemannten Raumfahrt gelungen sei. Immerhin ist er seinem Ziel näher gekommen, und er hat auch noch was zum Futtern dabei ...
Vollkommen schräg wird es, wenn jemand aus den Ergebnissen der Abiogenese-Forschung einen negativen Gottesbeweis konstruieren möchte. Das geht grauenhaft schief, wenn dieser Mensch an einen etwas beleseneren Kreationisten gerät. Ein moderner Theist, der in der Evolution die Schöpfungsmethode Gottes sieht, würde ihn sowieso nur belächeln, denn egal, was er erforscht, er würde immer nur die Spuren Gottes in der Schöpfung lesen.
Hans Trutnau am Permanenter Link
"Ich habe sicherheitshalber zunächst gegoogelt. Klar, 'Lipid' ist umfassender als 'Fett'."
Thomas, mir wurde (aber schon vor ca. 50 Jahren...) beigebracht: Lipid = Triglycerid = Fett.
Seit wann eigentlich sind Fettsäuren Bestandteil der Lipide?
Finde ich schräg.
Denn: WELCHE Fettsäuren? Alle Monocarbonsäuren? Nur Gradzahlige? Auch Ethan- ('Essig'-) säure? (Wohl kaum; denn die ist ja hydrophil.) Oder erst ab Butan- ('Butter-) säure? Fragen über Fragen... (auf die ich hier und jetzt keine Antwort erwarte).
"Ich vermute aber, dass man aus Decansäure keine stabile Membran basteln kann."
Die Natur vermutet ja nicht, bastelt einfach ein paar 'echte' Lipide mit rein. Aber egal.
Ich lese deine Kommentare immer wieder gern; speziell bzgl. eines Schöpfers.
Ein auch hier aktiver, genialer Kommentator postete mal auf FB 'seinen' Schöpfer:
Eine Nudelschöpfkelle... :-D
Manchmal (nein, immer häufiger) denke ich, der Schöpfergilde (bes. der Fundi-Gilde) kommst du nur mit beinhartem Spott bei. Spott sei Dank!
Thomas Waschke am Permanenter Link
@Hans Trutnau
"Manchmal (nein, immer häufiger) denke ich, der Schöpfergilde (bes. der Fundi-Gilde) kommst du nur mit beinhartem Spott bei. Spott sei Dank!"
Kommt darauf an, an wen du kommst. Hinsichtlich der Fundi-Gilde magst du Recht haben. Vergiss aber nicht, dass es auch Theologen gibt, die ihre Hausaufgaben gemacht haben.
Die Grundlage der Naturwissenschaften ist der *hypothetische* Realismus. Wenn du auch nur einen Moment nachdenkst und verstehst, was das bedeutet, merkst du schnell, dass man sich über bestimmte Gottes*bilder* durchaus amüsieren kann. Aber zu meinen, man hätte ein Argument gegen eine Übernatur, genauer, auch nur die Bedingung der Möglichkeit, darüber überhaupt eine gültige Aussage zu machen, ist naiv.
Klar, zum herzallerliebsten Jesulein führt so kein Weg, aber durchaus zur Möglichkeit einer, auch eingreifenden, Übernatur. Um hier gute Argumente zu haben, müssten wir weit mehr wissen, als aktuell der Fall ist. Denk nur an den Hype um das Miller-Experiment und was man damals alles meinte, nun zu wissen. Aus heutiger Sicht ist das so grenzenlos naiv, wie wohl Menschen in 50 Jahren über das sagen werden, was wir heute zu wissen meinen.
Hans Trutnau am Permanenter Link
Ich meinte bes. die Fundi-Gilde.
Thomas Waschke am Permanenter Link
"Ich meinte bes. die Fundi-Gilde."
"Wer von der weichgespülten Fraktion einen wie auch immer gearteten 'Trost' benötigt, hat nicht mit meinem Spott, sondern Mitleid zu rechnen - solange er/sie mich damit nicht behelligt."
Mir geht nur eine Gruppe auf den Senkel: Die weichgespülten, die auf Kreationisten eindreschen und dann meinen, Menschen wie uns mit im Boot zu haben. Die merken gar nicht, dass sie in deren Boot sitzen. Die wollen uns nach dem Motto 'der Feind meines Feindes ist mein Freund' als nützliche Idioten missbrauchen.
Ich muss schwer an mich halten, wenn ich Menschen wie Miller, Hemminger, Rhonheimer oder wen auch immer lese, die mit Akribie auf Intelligent Design-Vertretern herumhacken, nur um dann von einem Gott zu fabulieren, der sich im Quantenrauschen versteckt und dann auch noch meinen, Jesus sei auferstanden. Die vertreten doch exakt dasselbe wie die Intelligent Design-Vertreter, die meinen, dass der Designer eigenhändig Flagellen für Bakterien bastelt.
Hans Trutnau am Permanenter Link
Nenne es "Ironie, Sarkasmus oder sonst was", Thomas. Icch nenne es Spott.
Spott sei Dank!
Die "weichgespülten" haben mich jedenfalls nicht in ihrem Boot.
Thomas Waschke am Permanenter Link
Wir sind uns vollkommen einig, vor allem hinsichtlich deines letzten Satzes.
Denn der gilt meiner Meinung nach für den Artikel, über den wir gerade diskutieren. Das war eigentlich mein Punkt, dass aus Abiogenese über Weltanschauung nichts folgt und dass man die beiden Threads (wissenschaftliche Erforschung der Abiogenese und naturalistisches Weltbild) besser auseinander hält.
Jan Sütterlin am Permanenter Link
Danke für die angeregte Diskussion.
1) Ist Decansäure ein Lipid?
Sie gehört zur Klasse der Lipide, da sie ein Biomolekül ist, dass in sehr unpolaren Lösungsmitteln wie z.B. Hexan löslich ist. Diese Eigenschaft alleine ist allerdings nicht entscheidend für Selbstorganisation zu Mizellen oder Vesikeln. Der Säureteil des Moleküls bewirkt Amphiphilie, so dass die Substanz gleichzeitig sowohl lipophil (ölliebend) als auch hydrophil (wasserliebend) ist. Aufgrund dessen gehört dieses Molekül zur Klasse der Tenside. Dies würde treffender beschreiben wie es zur Selbstorganisation kommen kann. Allerdings ist der Begriff Doppellipidschicht im Bereich der Zellmembranen bekannt und gebräuchlich. Die große Schwierigkeit in populärwissenschaftlichen Artikeln ist es, nicht mit unbekannten Fachtermini wie hydrophil, hydrophob, lipophil, Tensid, Emulgator, etc. um sich zu werfen, sondern dies so weit es geht auf wenige zu reduzieren und trotzdem korrekt zu bleiben. Ein schwieriger Spagat.
2) Kann man aus Decansäure Membranen machen, die zu Wachstum und Zellteilung fähig sind?
Ja, dies wurde in der von mir zitierten Literatur 4 "Coupled Growth and Division of Model Protocell Membranes" für Decansäure (C10, gesättigt), Myristinsäure (C14, gesättigt) und Ölsäure (C18, ungesättigt) bewiesen. Es ist richtig, dass diese Membranen weniger stabil sind als Zellmembranen heutiger Lebewesen, allerdings war dies im Rahmen der vorgestellten RNA/Lipid-Welthypothese zu Beginn auch notwendig, da Nukleotide leicht durch die Zellmembran diffundieren müssen. In modernen Zellmembranen wird der Stofftransport durch eine Vielzahl von Kanälen streng kontrolliert.
3) Zur Interpunktion: Entschuldigung. Das ist sicherlich nicht meine Stärke.
Thomas Waschke am Permanenter Link
@Jan Sütterlin
"1) Ist Decansäure ein Lipid?
Sie gehört zur Klasse der Lipide,"
genauer: Man hat 'Lipid' so definiert, dass Decansäure dazu gehört.
"Aufgrund dessen gehört dieses Molekül zur Klasse der Tenside."
Eben. Und nun könnte man noch weitere Schächtelchen aufmachen und sich fragen, wie sich Tenside zu Lipiden verhalten, ob die Definitionen im Lauf der Geschichte gleich geblieben sind und so weiter.
"Ein schwieriger Spagat."
Unbestritten. Ein Problem entsteht nur, wenn man meint, auf dieser Basis Aussagen über freien Willen und so weiter machen zu sollen. Die einzige Entschuldigung besteht dann darin, dass man zunächst sich selber täuscht.
"2) Kann man aus Decansäure Membranen machen, die zu Wachstum und Zellteilung fähig sind?"
Hier ist der Begriff *Zell*teilung vollkommen falsch, weil die untersuchten Systeme keine Zellen sind. Und hier liegt wohl Ihr Denkfehler: Sie interpretieren minimale Ansätze für mögliche Teilschritte einer Abiogenese so weitgehend, dass Sie weltanschauliche Schlüsse daraus zu ziehen meinen können. Sie täuschen sich, weil die Sprache durch falsch interpretierte Begriffe 'feiert'.
Das ist aber kein Problem, das auf der Ebene der Chemie angegangen werden kann.
Hans Trutnau am Permanenter Link
"Die große Schwierigkeit in populärwissenschaftlichen Artikeln ist es, nicht mit unbekannten Fachtermini wie hydrophil, hydrophob, lipophil, Tensid, Emulgator, etc.
Darüber stolperte ich schon vor 2 Wochen - geriet in Vergessenheit, kam aber wieder hoch, weil ich hier ja selbst in puncto Tensid unterwegs bin...:
Der Spagat wird m.E. mit dem 'unbekannten' Fachterminus Decansäure sicher nicht weniger schwierig; erst recht mit dem (der *gesamten* Leserschaft tatsächlich unbekannten!) Terminus "Decanteil", der ja zudem nicht in allen Lipiden derselbe Teil (hier ein relativ kurzkettiger KW) ist. Und Decan, weil C10? Oder wäre Nonanteil (besser: Nonan-Teil) nicht richtiger, weil das 10. C im "Säureteil" -COOH enthalten ist? Jetzt wird es aber so richtig schwierig...
Ein Bildchen* (mit Bezeichnung, was da hydrophil, hydrophob ist) hätte da aus didaktischer Sicht 'Wunder' bewirkt. Und Fachtermini, sofern sie wirklich unbekannt sind (wozu ich hydrophil, hydrophob nicht unbedingt rechnen würde), lassen sich einfach verlinken; Wikipedia-Artikel bieten meist eine gut verständliche Einleitung an.
*Gibt es im Netz ja mannigfaltig unter dem Stichwort Tensid.
Rainer Bolz am Permanenter Link
Wir werden in absehbarer Zeit erfolgreich die Geheimnisse der Schöpfung entschlüsseln. Enträtseln wir nämlich alle Geheimnisse des Lebens benötigt es auch keinen Schöpfergott mehr.
Die Entwicklung geht jedenfalls rasant voran und wer möchte solche Forschungsarbeiten am liebsten verbieten ? - Genau, Kardinäle und Bischöfe, deren Geschäftsmodell in zunehmenden Maße immer mehr abhandenkommt.
Danke für den Beitrag.
Klemens am Permanenter Link
Wer einen "Schöpfergott" im Portfolio hat, muss sich normalerweise immer fragen, woher kommt dieser eigentlich?
Thomas Waschke am Permanenter Link
@Klemens:
Streng genommen nicht, denn Theologen betrachten einen Gott als etwas 'Unbedingt Seiendes'. Nach dessen Herkunft zu fragen ist in etwa so sinnvoll wie die Frage, was nördlicher als der Nordpol sei.
Man kann auch das Kalam-Argument bemühen. Dann ist nur die Herkunft dessen zu erklären, was nicht ewig ist. Gott wird als ewig gedacht.
Dawkins wird von Theologen nicht besonders ernst genommen, weil er genau das als zentrales Argument in seiner 'The God Delusion' benötigt. Er zeigt damit eigentlich nur, dass er die Argumentation der Gegenseite nicht kennt, aber meint, sie widerlegt zu haben.
Klemens am Permanenter Link
@Thomas
Thomas Waschke am Permanenter Link
@Klemens
"Ich glaube, man kann diese Dimension nicht mehr mit unseren Worten beschreiben."
100 Prozent Übereinstimmung. Genauso wenig, wie man die Eigenschaften eines Gottes (sollte es einen geben ...) beschreiben könnte.
Es geht deshalb eher darum, wie man in einer Diskussion mit Menschen, die ein Gottes*bild* vertreten, argumentiert. Wenn diese Menschen betonen, dass ihr Gott ewig sei, ist es sinnlos, zu fragen, woher dieser Gott kommt, weil man dann zwei Sprachspiele mischt. Das wird dann so 'sinnvoll' wie die Antwort 'rot' auf die Frage, wie schnell ein Auto sei. Ein Argument gegen das Gottesbild hat man so nicht, man begeht einfach einen Kategorienfehler.
Es ist beispielsweise zielführender, zu fragen, wie der theistische Diskussionspartner *begründet*, dass sein Gott ewig sei. Das führt dann zu einer Diskussion, was eigentlich eine Begründung ist und man wird sich letztlich auf inkommensurable Weltbilder einigen müssen. Aber man wird trotzdem erkennen, dass die Frage 'Wer hat den Schöpfer erschaffen?' keinen Sinn macht.
Sven F am Permanenter Link
Man könnte doch einfach antworten: Ich sehe das Universum als ewig.
Wer hätte dann "gewonnen"? ;-)
Thomas Waschke am Permanenter Link
@Sven F:
Wir Naturalisten, weil dann das Kalam-Argument wegfällt ;-)
Thomas Waschke am Permanenter Link
@Jan Sütterlin
"Wir sollten uns darauf vorbereiten, dass die Entschlüsselung des Ursprungs des Lebens eine vergleichbar heilsame Revolution unseres Selbstverständnisses zur Folge haben wird."
Unser Selbstverständnis ist von den Ergebnissen der Abiogenese-Forschung vollkommen unabhängig, wenn man einer anderen Richtung des Intelligent Design anhängt, das beispielsweise auch die Großkirchen vertreten. Das kann man an besten anhand eines Witzes zeigen (wenn es jemanden interessiert, kann ich gerne die Quelle herauskramen): Die Wissenschaft hat alle Fragen geklärt. Nun wird jemand gesucht, der Gott beibringt, dass man ihn nicht mehr braucht. Einer geht zu Gott und trägt das vor und schlägt ein Wettschöpfen vor. "Menschen?" fragt Gott. "Okay", sagt der Forscher, und bückt sich, um eine Handvoll Erde aufzuheben. "Nicht mogeln", sagt Gott, "mach gefälligst deinen Lehm selber!".
Schon daran siehst man, dass jemand, der sein Selbstverständnis auf Gott gründet, vollkommen gelassen darauf warten kann, was die Wissenschaft alles herausfindet. Gott hat die Materie und die Naturgesetze erschaffen, und die hat via Evolution das generiert, was er wollte. Es könnte sogar sein, dass man herausfindet, dass das gar nicht funktionieren kann, wenn Gott nicht ab und an eingreift, eventuell so, dass man das nicht merken würde. Ein Meteoriteneinschlag hier, ein zufälliges Ereignis dort ...
Ich sehe nicht, welche heilsame Revolution auch nur prinzipiell hier stattfinden könnte, die in der Theologie nicht schon längst erfolgt ist. Das Gottes*bild* hat sich gewandelt, die alten Mythen sind eh obsolet.
Jan Sütterlin am Permanenter Link
Ich denke schon, dass ein naturalistisches Verständnis der Abiogenese einen großen Einfluss auf unser Selbstbild hat.
Thomas Waschke am Permanenter Link
"Aber diese Diskussion führt hier zu weit."
Stimmt, es reicht vollkommen, einzusehen, dass Abiogenese hinsichtlich dieser Fragen vollkommen irrelevant ist. Zudem ist bisher viel zu wenig über Abiogenese bekannt, um daraus irgendwelche Schlüsse zu ziehen, denn noch niemand konnte zeigen, dass das überhaupt naturalistisch funktionieren kann. Bevor das nicht geklärt ist, sind alle weiter gehenden Überlegungen, die Sie anstellen, sinnleer. Glasperlenspiele, bestenfalls schlechte Philosophie.
Sven F am Permanenter Link
"Ich sehe nicht, welche heilsame Revolution auch nur prinzipiell hier stattfinden könnte, die in der Theologie nicht schon längst erfolgt ist.
In der Theologie vielleicht schon, die Pfaffen predigen trotzdem noch die Mythen als Realität von der Kanzel. Da das das Einzige ist, was der Ottonormalbürger von seiner Religion erzählt bekommt, finde ich die Kritik an den Mythen immer noch gerechtfertigt - solange sich die Theologen nicht darum kümmern, dass ihr neues Gottesbild auch bei den Schäfchen ankommt.